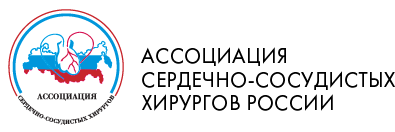Протезирование митрального клапана у детей раннего возраста
ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева» РАМН, Москва
* Адрес для корреспонденции: abu1967@mail.ru
На протяжении многих лет бытует спорный вопрос: Что выгоднее? Что целесообразнее и что предпочтительнее выполнять при врожденной клапанной патологии митрального клапана (МК) у детей раннего возраста: реконструкцию или протезирование.
Безусловно, предпочтительными являются реконструктивные операции, которые следует рассматривать как процедуру оптимального выбора у детей раннего возраста. Реконструкция у правильно отобранных пациентов дает удовлетворительные отдаленные результаты и меньшее количество осложнений, чем протезирование, а также отсутствует необходимость постоянного применения антикоагулянтов [2, 3, 7, 8]. Однако, грубая сочетанная патология клапанов в этой возрастной группе делает восстановительные операции неэффективными и порой невозможными. Более того, частое сочетание патологии клапанов у детей с другими врожденными пороками сердца вызывает особые технические трудности. Для данной категории больных по мнению большинства кардиохирургов замещение клапана на механический протез является рациональным выбором хирургической тактики [1, 4, 5, 6].
В Научном центре сердечно-сосудистой хирургии (НЦССХ) им. А.Н.Бакулева РАМН накоплен большой опыт выполнения операций по протезированию клапанов сердца при их врожденной патологии у маленьких пациентов, в том числе и при поражении митрального клапана, результаты которого представлены в нашем сообщении.
Целью нашего исследования явился анализ 13 летнего опыта по протезированию митрального клапана у детей раннего возраста.
Материалы и методы: Нами проанализированы результаты протезирования митрального клапана у детей раннего возраста за период с 1997 по 2010гг. В НЦССХ им. А.Н.Бакулева за 13 летний период 104 больным было выполнено протезирование митрального клапана. Возраст пациентов варьировал от 23 дней до 4 лет (в среднем 12±8 месяцев). 36 (34,6%) детей были в возрасте до 1 года (табл. 1). Средний вес пациентов составил 9,2±3,6 кг (от 3,2 кг до 19 кг).
| Пол | Возраст | Количество пациентов | |||
| до 1 года | от 1 до 2 лет | от 2 до 4 лет | n | % | |
| Мужской | 14 | 23 | 7 | 44 | 41,7 |
| Женский | 22 | 27 | 11 | 60 | 58,3 |
| Всего | 36 | 50 | 18 | 104 | 100 |
Причиной некомпетентности левого атриовентрикулярного клапана у 36,5% больных явилась врожденная изолированная недостаточность митрального клапана (ВНМК), а у 21,2% пациентов- предшествующая неудачная радикальная коррекция атриовентрикулряной коммуникации. В 10,6% случаев ВНМК сочеталась с дефектом межжелудочковой (ДМЖП) или межпредсердной перегородки (ДМПП), в 11,5%- отхождением левой коронарной артерии от легочного ствола, в 6,7%- с коарктацией аорты, в 2,9%- с клапанным стенозом аорты и в 2,9% митральная недостаточность сочеталась с трикуспидальной недостаточностью. В 6,7% случаев был диагностирован врожденный комбинированный митральный порок (стеноз+недостаточность). У 1(1,0%) пациента причиной недостаточности митрального клапана явился бактериальный эндокардит. У 32-х пациентов был выявлен генетический синдром Дауна и у 2-х синдром Марфана.
При физикальном обследовании у всех пациентов выявлялись признаки недостаточности кровообращения той или иной степени выраженности, сопровождавшиеся одышкой, снижением физической активности, а в тяжелых случаях хрипами в легких. Большинство больных отставали в физическом развитии, многие из них имели гипотрофию II-III степени.
| Группа | Форма порока | Кол-во наблюдений | |
| n | % | ||
| 1. | Врожденная изолированная недостаточность митрального клапана | 38 | 36,5 |
| 2. | Митральная недостаточность после радикальной коррекции ООАВК | 22 | 21,3 |
| 3. | Митральная недостаточность в сочетании с септальными пороками (ДМПП и ДМЖП) | 11 | 10,6 |
| 4. | СБУГ | 12 | 11,6 |
| 5. | Митральная недостаточность в сочетании с коарктацией аорты | 7 | 6,7 |
| 6. | Врожденный комбинированный митральный порок (стеноз+недостаточность) | 7 | 6,7 |
| 7. | Митральная недостаточность в сочетании с клапанным стенозом аорты | 3 | 2,6 |
| 8. | Врожденная недостаточность митрального клапана + трикуспидальная недостаточность | 3 | 2,6 |
| 9. | Бактериальный эндокардит | 1 | 1,0 |
| Всего | 104 | 100 | |
Основным методом диагностики поражения МК явилось эхокардиографическое исследование, посредством которого определялись фракция регургитации, состояние клапанных структур и размеры полостей левого желудочка и левого предсердия. Следует отметить, что у всех больных фракция регургитации превышала 75%. Регургитация на МК варьировала от 3 степени до тотальной недостаточности. При измерении полостей сердца было выявлено увеличение параметров левого предсердия в два и более раза по сравнению с возрастной нормой, а такие показатели как конечный систолический размер и конечный диастолический размеры левого желудочка были увеличены на 40-65% от возрастной нормы. У всех больных была снижена «эффективная» фракция выброса левого желудочка (ФВ ЛЖ) за счет выраженной регургитации на МК, а у детей с аномальным отхождением левой коронарной артерии помимо всего вышесказанного отмечалось снижение сократительной функции миокарда вследствие патофизиологии основного порока- ФВ ЛЖ колебалась от 22 до 45%. Среднее давление в системе легочной артерии у 18 (17,3%) пациентов было свыше 50 мм рт. ст.
Окончательное решение о протезировании пораженного клапана принимали интраоперационно после оценки анатомических изменений клапанных структур. Основанием для замещения митрального клапана на искусственный механический протез было отсутствие возможности выполнения пластики ввиду грубых морфологических изменений. При ревизии у всех пациентов отмечалась выраженная дилатация фиброзного кольца. У 56% пациентов отмечалось миксоматозное изменение створок клапана (рис. 1), а у остальных больных отмечалось либо грубое утолщение передней створки, либо выраженная гипоплазия задней створки с утолщением или спаянием со свободной стенкой левого желудочка (рис. 2). Изменения в хордальном аппарате были представлены либо удлинением, либо укорочением хорд, т.е. нарушением корреляционной связи между длиной хорд и сосочковых мышц. Среди аномалий развития сосочковых мышц отмечалась их гипоплазия, вплоть до аплазии, а также дистопия. У 16 (15,4%) пациентов с выраженной недостаточностью на митральном клапане присутствовали изменения во всех его структурах.
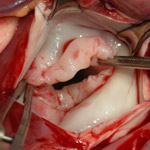
Рис.1. Отмечается соединительнотканная
дисплазия створок митрального клапана с
гипоплазией хорд и сосочковых мышц.

Рис.2. Иссечен миксоматозно измененный
митральный клапан, припаянный к сосочковой
мышце, хорды отсутствуют.
Доступ к сердцу осуществляли посредством срединной стернотомии, обеспечивающей хорошую визуализацию всех структур, что является необходимым для устранения сопутствующих пороков сердца. Подключение аппарата искусственного кровообращения проводили по принятой схеме с пристеночной канюляцией верхней полой вены для наилучшей экспозиции предсердно-желудочковых клапанов. Протезирование МК выполняли в условиях гипотермической перфузии (28°С) и комбинированной фармакохолодовой кардиоплегии («Кустодиол»). Доступ к МК осуществляли через правое предсердие и межпредсердную перегородку. Во всех случаях иссекалась передняя створка МК вместе с подклапанным аппаратом, что необходимо для нормального функционирования запирательных элементов механического клапана. Задняя створка с подклапанным аппаратом с целью сохранения геометрии левого желудочка не иссекалась. В большинстве случаев размеры фиброзного кольца МК позволяли имплантировать клапан непосредственно в аннулярную позицию с фиксацией его П-образными швами Etibond 4/0. У 15 (14,4%) детей при узком фиброзном кольце использовалась методика супрааннулярного протезирования. Время искусственного кровообращения составило от 67 до 245 мин.
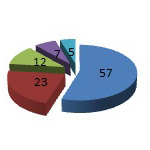
Рис.3. Перечень искусственных
механических клапанов сердца,
имплантированных в митральную
позицию у детей раннего возраста.
Из 104 случаев митрального протезирования в 57- использован клапан фирмы «St. Jude Medical», в 23 - «Carbomedics», «АТS»-у 12 пациентов, в 7-«Мединж» и в 5 случаях «МИКС» (рис. 1). Размеры искусственных клапанов сердца колебались от 16 мм («АТS») до 27 мм («St. Jude Medical») (рис.3).
РезультатыВ раннем послеоперационном периоде летальность составила 16 (15,4%) пациентов. Основной причиной смерти послужила травматичность операции и острая сердечная недостаточность как пусковой фактор, с развитием в последующем полиорганной недостаточности.
По мере улучшения хирургической техники и усовершенствования дооперационной диагностики в плане четкой дифференцировки клапанов, не пригодных к реконструкции, и установления абсолютных показаний к протезированию в течении последних 2 лет мы добились снижения госпитальной летальности у детей раннего возраста до 6,6%.
Осложненный послеоперационный период наблюдался у 35 (35,6%) пациентов. На первом месте среди осложнений была сердечная недостаточность - у 17 (16,3%) детей ввиду исходно тяжелого состояния миокарда левого желудочка; на втором - осложнения со стороны органов дыхания - 10 (9,6%) малышей, что требовало пролонгированной искусственной вентиляции легких и более длительного пребывания пациентов в отделении реанимации. У 5 (4,8%) пациентов имелись нарушения ритма в виде полной поперечной блокады, что потребовало имплантацию искусственного водителя ритма. У 1 младенца имело место развитие внутренних кровотечений в плевральные и брюшную полость на фоне нарушения свертывающей системы крови в виде гипокоагуляции и гипофибринемии. Среди осложнений, потребовавших хирургического вмешательства (репротезирование МК) в ранние сроки после операции, особо следует отметить развитие парапротезной фистулы (1 ребенок) и ранний тромбоз имплантированного клапана у ребенка с первичным бактериальным эндокардитом.
| Осложнения | Количество случаев | |
| n | % | |
| Острая сердечная недостаточность | 17 | 16,3 |
| Дыхательная недостаточность | 10 | 9,6 |
| Нарушения ритма сердца и проводимости | 5 | 4,8 |
| Кровотечение | 1 | 0,9 |
| Парапротезная фистула | 1 | 0,9 |
| Тромбоз клапана | 1 | 0,9 |
В ряде случаев при развитии тяжелой посткардиотомной сердечной недостаточности в ближайшем послеоперационном периоде были использованы системы вспомогательного кровообращения, такие как внутриаортальная баллонная контрпульсация (у 1 ребенка) и экстракорпоральная мембранная оксигенация- в 2 случаях.
Неосложненный ранний послеоперационный период наблюдался у 69 (66,3%) пациентов. После перевода в отделение интенсивной терапии у них отмечалась стабильная гемодинамика при поддержке терапевтическими дозами кардиотоников: допамина - не более 6 мкг/кг/мин, добутамина - не более 8 мкг/кг/мин. Среднее время искусственной вентиляции легких составило 16±3,8 часа. На вторые сутки после операции больных переводили в отделение, где в дальнейшем у них наблюдалось постепенное улучшение состояние с заживлением раны первичным натяжением.
12 (11,5%) больных с осложненным послеоперационным периодом были выписаны из стационара спустя в среднем 22±5,2 дня после операции (от 17 до 26 дней), а те пациенты, послеоперационный период у которых протекал без осложнений,- в среднем на 11±3,2 сутки (от 7 до 14 суток).
Все пациенты в послеоперационном периоде получали антикоагулянтную терапию. Сразу же после операции назначали гепарин (из расчета 200 ЕД/кг/сут каждые 6 часов) с последующим переходом на непрямые антикоагулянты (варфарин) в дозе 0,09 мг/кг/сут. Коррекция антикоагулянтной терапии проводилась под контролем показателей свертывающей системы крови- протромбиновый индекс (ПТИ) и международное нормализованное отношение (МНО). Мы добивались достижения уровня МНО-2-3,5 и протромбинового индекса 35-50%.
Ближайшие результаты оценивались спустя в среднем 6 месяцев после операции. За этот период летальных случаев не было. Все больные находились в домашних условиях под амбулаторным наблюдением специалистов по месту жительства. Клапанозависимых осложнений не наблюдалось. У всех пациентов было отмечено уменьшение размеров полостей сердца. По данным рентгенографии кардиоторакальный индекс уменьшился в среднем на 8-10%. Во всех случаях отсутствовал венозный застой, нормализовался легочной рисунок. Оценка работы искусственных сердечных клапанов методом эхокардиографии не выявила нарушений их функций, при этом пиковый градиент давления составлял от 7 до 12 мм рт.ст., а средний градиент - от 5 до 7 мм рт.ст.
Отдаленные результаты оценивались спустя год и более после операции. Однако по независящим от нас причинам с некоторыми больными связь была утрачена. Через год после операции обследовано 81 пациент, через 2 года - 65, через 5 лет - 59 пациентов. Максимальный срок наблюдения за больными, перенесшими протезирование митрального клапана в раннем детском возрасте в настоящее время составляет 10 лет.
По данным инструментальных методов исследования, у всех обследованных пациентов отмечаются позитивные изменения. Уже через полгода при выполнении рентгенографии органов грудной клетки выявляется сокращение размеров сердца, причем в дальнейшем эта тенденция сохраняется и уже через 1 год после операции наблюдается значимое уменьшение КТИ: от 51% до 63% (в среднем 57%). Помимо этого у 68 (65,4%) детей отмечается нормализация легочного рисунка с уменьшением признаков венозного застоя. Эхокардиографическое исследование, выполненное в отдаленном послеоперационном периоде, также демонстрирует положительные изменения. Отмечено сокращение линейных размеров и объемных характеристик ЛЖ: средние показатели КДР ЛЖ-2,7 см и КДО ЛЖ - 87мл/м?. Функция протезов хорошая, движение запирательных элементов в полном объеме. Колебания пикового градиента давления на митральном протезе составляют от 7 до 20 мм рт.ст., среднего от 7 до 14 мм рт.ст. Значимой регургитации на имплантированных протезах не обнаружено. Нарастание градиентов на протезе без дисфункции отмечается у 9 (8,6%) пациентов: пиковый градиент на клапане 19-24мм рт.ст. Подобная ситуация связана, по всей видимости, с ростом детей, увеличением поверхности тела, так называемым перерастанием размера имплантированного клапана. Эти пациенты составляют группу наиболее длительного наблюдения- от 3,5 до 8 лет. При этом клиническое состояние детей не нарушено. Они активны, у них практически отсутствует одышка, а также какие- либо признаки недостаточности кровообращения. В то же время эти дети находятся под динамическим наблюдением как возможные кандидаты на репротезирование.
Следует отметить, что через 2 года после операции у большинства пациентов отсутствуют жалобы, размеры полостей сердца по данным эхокардиографии соответствуют возрастным нормам. Примечателен тот факт, что более половины детей перенесших протезирование митрального клапана, спустя два года после операции относятся к Iст. недостаточности кровообращения, т.е. считаются практически здоровыми.
В отдаленном послеоперационном периоде у 6 пациентов в связи с перерастанием размера протеза произведено репротезирование митрального клапана.
После протезирования митрального клапана, несмотря на то, что все больные были вынуждены принимать антикоагулянты и регулярно контролировать показатели свертывающей системы крови, отмечено улучшение качества их жизни. Дети стали меньше болеть простудными заболеваниями, сократилось количество принимаемых препаратов, что немаловажно для психологического состояния как для самих пациентов, так и для их родителей.
ЗаключениеПротезирование митрального клапана у детей раннего возраста является эффективным методом хирургического лечения выраженной недостаточности левого атриовентрикулярного отверстия. Показанием к протезированию митрального клапана у детей раннего возраста является наличие грубой патологии во всех его структурах (дилатация фиброзного кольца с нарушением развития створок, хорд и сосочковых мышц), приведших к тотальной регургитации. При выборе протеза для имплантации в митральную позицию у детей раннего возраста предпочтение следует отдавать низкопрофильным двустворчатым искусственным клапанам сердца. Вопрос о сроках замены протеза решается строго индивидуально, исходя из данных клинического и инструментального методов обследования совместно с кардиологом и кардиохирургом.
Иллюстрации к статье
1. Бокерия, Л. А. Протезирование митрального клапана у детей раннего возраста при ВПС /Л. А. Бокерия, К. В. Шаталов, А. А. Свободов, Т. И. Мусатова и др. //Грудная и сердечно- сосудистая хирургия. –М.,-2003.-№3.–С.16-19.
2. Бокерия, Л. А. Врожденная недостаточность митрального клапана /Л. А. Бокерия, И. И. Каграманов, Ю. И. Бондарев.–М: Изд-во НЦССХ им А.Н.Бакулева. 2003.–112с.
3. Бокерия, Л. А. Нормативные параметры предсердно- желудочковых клапанов по результатам морфометрических исследований / Л. А. Бокерия, О. А. Махачев, М. С. Панова, Т. Ю. Мосевская //Сердечно- сосудистые заболевания. -2005.–Т.6.-№1.–С.5-25.
4. Дробот, Д. Б. Протезирование клапанов сердца у детей: дисс… д-ра. мед. наук / Д. Б. Дробот. –М., 2004.-248с.
5. Железнев, С.И. Клинико- гемодинамическая оценка результатов операций протезирования митрального клапана с сохранением подклапанных структур при митральной недостаточности /С. И. Железнев. //Патология кровообращения и кардиохирургия. –2007.-№3.–С.20-24.
6. Adams, D.H. Current Concepts in mitral valve repair for degenerative disease /D. H. Adams, A. C. Anyanwu, P. B. Rahmanian, F. Filsoufi //Heart Fail Rev.-2006.-V.11.-P.241-257.
7. Paul, W.M. Evolving concepts and technologies in mitral valve repair / W. M. Paul, M. D. Fedak, M. Mc Carthy Patrick, O. Robert //Circulation.-2008.-V.117.-P.963-974.
8. Suri, R.M. Recurrent mitral regurgitation after repair: should the mitral valve be re- repaired? / R. M. Suri, H. V. Schaff, J. A. Dearani, T. M. Sundt, R. C. Daly, C. J. Mullany, M. Enriquez- Sarano, T. A. Orszulak //J. Thorac. Cardiovasc. Surg. –2006.-V.82.-P.1390-1397.